 Osztódó ráksejtek (Forrás: Wikipedia)
Osztódó ráksejtek (Forrás: Wikipedia)Egy igen átfogó kutatásban 22 különböző tumortípus génkifejeződéséről összegyűjtött adatokat elemezték. Kiderült, hogy bár a daganatok egyes anyagcsere-folyamatai gyakran hasonlóak, általában véve mégsem mondható, hogy az anyagcserében bekövetkező változások minden tumorra egyformán jellemzőek lennének. Éppen ellenkezőleg: a különféle tumortípusokban különféle anyagcsere-változások következnek be, és a tumorok egyéni mechanizmusokat alkalmazva tartják fent a saját osztódásukat, növekedésüket. Az egyéni anyagcsere-folyamatokat megcélozva azonban számos új gyógyszert ki lehetne fejleszteni.
Rákkutatással kapcsolatos anyagaink:
Magyar rákkutatót is meghívtak a giga technológiai világkiállításra Szaúd-Arábiába
A daganatsejtek DNS-ének feldarabolása is hatékony lehet a rákkezelésben
Gyógyszer nélkül is lehetne pusztítani a rákot
Az anyagcsere - idegen szóval metabolizmus - a sejteken belül zajló reakciók folyamatosan változó hálózata, amelyek a tápanyagok feldolgozását végzik. Ilyen tápanyag a szőlőcukor - vércukor, illetve glükóz - amelyből a sejtek energiához, illetve olyan molekulákhoz jutnak, amelyekből előállíthatók a sejt különféle alkotórészei.
Elsőként egy Nobel-díjas német biokémikus, Otto Warburg ismerte fel 1924-ben, hogy a ráksejtek anyagcseréje eltér az egészséges sejtekétől. Ez szükségszerű is, hiszen a kontrollálatlan osztódást egyébként nem tudnák végrehajtani. A tumorsejtek - gyors növekedésük és osztódásuk érdekében - szinte habzsolják a glükózt, amit ráadásul máshogyan használnak fel, mint a normális anyagcserével jellemezhető, egészséges sejtek.
Miért fontos, hogy megértsük a daganatos sejtek anyagcseréjét?
"Annak ellenére, hogy nagyrészt már feltérképeztük az egészséges sejtek anyagcsere-folyamatait, még mindig nem értjük teljesen, hogy ezek a folyamatok miként változnak meg a daganatos sejtekben" - mondja dr. Dennis Vitkup, a New York-i Columbia Egyetem professzora, aki munkatársaival egy újszerű és igen érdekes tanulmányt publikált a Nature Biotechnology című folyóiratban.
Vitkup és kollégái - sok más kutatóval együtt - azt szeretnék tisztázni, hogy miként lehetne úgy beleavatkozni ezekbe a megváltozott anyagcsere-folyamatokba, hogy azzal "kiéheztessék" a daganatsejteket. Ez egy mostanában újraéledő kutatási vonal, az utóbbi évtizedben ugyanis elsősorban a daganatkialakulás genetikai okaira koncentráltak a szakemberek. Mára azonban - sok igen jelentős eredmény mellett - az is kiderült, hogy a hibás gének gátlása, vagyis a célzott daganatterápia sem fog egy csapásra mindent megoldani.
Ennek egyik fő oka, hogy általában még a célzott gyógyszerek is képtelenek arra, hogy a rák magvának nevezhető daganatos őssejteket is elpusztítsák. Ezen kívül többféle gén is meghibásodhat, jelátviteli útból pedig igen sokféle van. A ráksejt így képes lehet rá, hogy "váltson", és ne a célzottan már gátolt, hanem egy alternatív jelátviteli útvonalon juttassa el a "növekedj és osztódj" parancsot a sejtmagba.
Ezt a jelenséget nevezik gyógyszer-rezisztenciának. A daganatos őssejtek elpusztításán kívül talán azzal is meg lehetne oldani ezt a problémát, ha sikerülne teljességgel elvágni a tumorok energiaellátását. Ehhez viszont pontosan kellene érteni a tumoranyagcsere sajátosságait, majd úgy beleavatkozni ezekbe a folyamatokba, hogy a daganatsejtek többé ne legyenek képesek a további osztódásra és növekedésre.
A kulcsprobléma: nincs univerzális "tumoranyagcsere"
Vitkup és kollágáinak tanulmánya azért jelent fontos újdonságot, mert világosan rámutat: a tumorossá vált sejtek anyagcseréjében nincsen egyféle és minden daganatra egyformán érvényes változás. Ez pedig azt jelenti, hogy a daganat-anyagcserét érintő változások megértéséhez egyenként kell majd tisztázni, hogy a különféle tumorok hogyan igazítják működésüket a saját egyéni igényeikhez - írja a Columbia Egyetem sajtóanyaga.
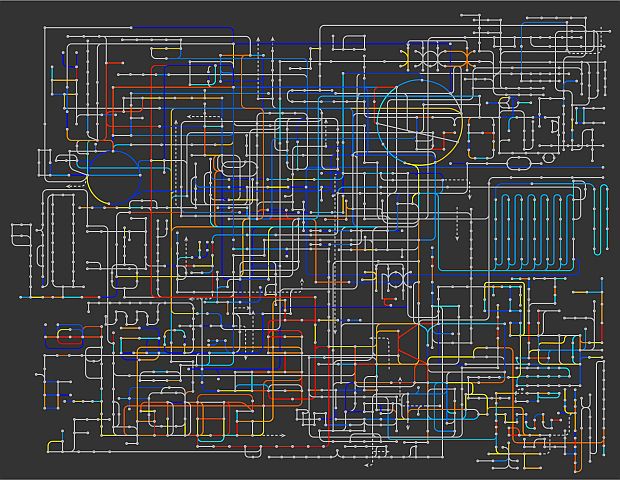
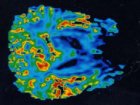
A fenti képen a daganatos és az egészséges sejtek anyagcseréjének összehasonlítása látható a gének kifejeződésének mértéke alapján. Piros színű vonalakkal jelölték, ahol egy bizonyos fajta enzim aktivitása megnő a tumorokban az egészséges szövetekhez képest. A kék színű vonalak pedig azt jelzik, ahol a tumorok emzimaktivitása csökkent mértékű az egészséges sejtekéhez képest. (Forrás és a kép nagy méretben: Columbia Egyetem, Dennis Vitkup)
Ennek fényében érthető, hogy a tumoranyagcseréről szerzett eddigi tudásunk miért nem volt elegendő ahhoz, hogy egyetlen vegyülettel gátoljuk a létező összes tumor energiaellátását. A tumoranyagcsere néhány változása ugyan valóban gyakori - ilyen például a fokozott nukleotid-szintézis vagy a glükózmolekulák oxigén nélkül történő elégetése - más anyagcsere-folyamatok azonban nagyon is különböznek.
Ilyen - a tumorok anyagcseréjében különféleképpen megváltozó - folyamat a glükózmolekulák oxigén jelenlétében történő elégetése, amely nem a sejt növekedését és osztódását, hanem a daganatsejt energiaellátását hivatott biztosítani. (A glükóz oxigén nélküli elégetését glikolízisnek, az oxigén jelenlétében történő felhasználását pedig oxidatív foszforilációnak nevezik - a szerk.)
Hogyan lehetnének ebből a felismerésből új gyógyszerek?
A Columbia Egyetem kutatói egy valóban átfogó, nagy volumenű vizsgálatot terveztek, amelyben 22-féle daganattípusban elemezték a gének kifejeződését, majd megnézték, hogy a génműködés milyen anyagcsere-folyamatokkal függ össze. Az így kapott eredményekből derült ki, hogy a daganatok anyagcseréjében bekövetkező változásokat korántsem lehet általánosítani.
A kutatók közleménye több ilyen példát is felsorol. Az egyik az úgynevezett izoenzimekre vonatkozik: ezek olyan enzimek, amelyek gyakran ugyanazokat a reakciókat gyorsítják fel (katalizálják), de eltérő sebességgel. A vese- és májrákok esetében például kimutatták, hogy a daganatokban gyakoribb volt az egyik - gyors sejtnövekedést elősegítő - izoenzim "gyors változatának" jelenléte, a normál szövetekben viszont az izoenzim lassabban működő formája volt jellemző. A kutatók ezen kívül több száz olyan izoenzimet azonosítottak, amelyeknél - az iménti példához hasonlóan - hasonló különbségeket találtak a daganatos és a normál szövetekben. Ezek az izoenzimek jelentik az egyik lehetőséget, ahol új gyógyszerekkel szelektíven lehetne gátolni a tumorsejteket (vagyis úgy, hogy a gyógyszerek ne befolyásolják az egészséges sejteket).
Az anyagcserébe történő gyógyszeres beavatkozás másik lehetséges példája az agydaganatokra és az akut mieloid leukémiára jellemző egyik enzim. Ez az enzim egy olyan anyagcsereterméket állít elő, amely jelentősen elősegíti a daganatnövekedést. Kiderült, hogy az agydaganatokra és a leukémia ezen típusára leginkább jellemző, gyakran visszatérő génmutációk éppen ennek az enzimnek a termelődését fokozzák. A mutációk gyakori előfordulása nem tűnik véletlennek, hiszen a daganat így egy olyan "enzimgyárat" működtethet, amellyel sikeresen fenntartja a saját növekedését. Gyógyszeres úton azonban hatékonyan meg lehetne szakítani ezt az önfenntartó kört.
Vastagbélráknál ugyancsak sikerült két olyan enzimet találni, amelyek sokkal kevésbé voltak aktívak, mint a normális, egészséges szövetekben. Ez a csökkenés két olyan anyagcseretermék felhalmozódását okozta a tumorsejtekben, amelyek daganatkeltő hatásukról ismertek. Még hosszan lehetne folytatni a sort, a lényeg azonban az, hogy a következő években talán olyan új gyógyszereket is sikerül majd kifejleszteni, amelyekkel "tumortípusra szabottan" lehet majd beavatkozni a daganatok anyagcseréjébe.
* * *
Kapcsolódó anyagok:
A Columbia Egyetem sajtóanyaga:
Study Identifies Hundreds of Potential Drug Targets to Starve Cancer
Az eredeti, teljes terjedelmében is olvasható cikk:
Heterogeneity of tumor-induced gene expression changes in the human metabolic network
A New York Times korábbi, kapcsolódó cikke:
Tisztelt Olvasónk! Felhívjuk a figyelmét, hogy anyagaink tájékoztató és ismeretterjesztő jellegűek, így nem adhatnak választ minden olyan kérdésre, amely egy adott betegséggel vagy más témával kapcsolatban felmerülhet, és főképp nem pótolhatják az orvosokkal, gyógyszerészekkel vagy más egészségügyi szakemberekkel való személyes találkozást, beszélgetést és gondos kivizsgálást.