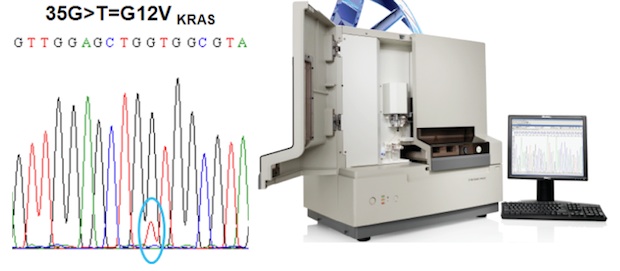
 A vastagbélrákokban leggyakrabban előforduló KRAS mutáció és az azt detektáló Sanger szekvenátor. Forrás: KPS
A vastagbélrákokban leggyakrabban előforduló KRAS mutáció és az azt detektáló Sanger szekvenátor. Forrás: KPSAz Európai Patológusok Társasága (European Society of Pathologists) által szervezett európai KRAS EQA körvizsgálat céljaként a KRAS vizsgálatok megbízhatósági elemzését tűzte ki. Magyarországról egyelőre egyedüliként a KPS Molekuláris Diagnosztikai Központ vett részt a vizsgálatban, hibátlan eredménnyel.
Onkológiai diagnosztikai hírek:
Háttéranyag
Az idei körvizsgálatban 27 labor küldte be eredményeit a koordináló központ számára, melyből 21, köztük a KPS Molekuláris Diagnosztikai Központ ért el 10/10 arányt a genotípusok meghatározásának tekintetében.
A KRAS mutációs státusz a vastagbélrákok legfontosabb farmakodiagnosztikai markere: Amennyiben a daganatban nincs jelen KRAS mutáció, az EGFR-gátló terápia sok esetben hatékony. Ezzel szemben a KRAS mutáns daganatokban az EGFR gátló szerek kifejezetten károsak, a betegek túlélését rövidítik.
A KRAS mutációk kimutatására leggyakrabban alkalmazott módszer a Sanger-féle dideoxi-szekvenálás, melyet a 27 labor közül 12-en használtak, valamint a TheraScreen DxS rendszer, melyet öten alkalmaztak. Az átlagos eredmény 94%-osnak mutatkozott. Az eredményeket Prof. Dr. J. Van Krieken és Prof. Dr. E. Dequeker hagyták jóvá.
Dr. Pintér Ferenc, a KPS Molekuláris Diagnosztikai Központ mutáció detektálási módszereit fejlesztő kutatója kérdésünkre elmondta, hogy bár a Sanger-féle dideoxi-szekvenálás használatával a 100%-os szelektivitás elérhető, tehát az álpozitív eredmény kizárható, de a módszert csak önmagában alkalmazva egyes minták esetében az érzékenység (szenzitivitás) nem megfelelő, azaz a vizsgálat álnegatív eredményt adhat. Ennek megértéséhez tudnunk kell, hogy a szövetminta nem csak daganatos sejteket tartalmaz, hanem minden esetben egészségeseket is, viszont a keresett szomatikus mutáció csak a daganatos sejtekben fordul elő, az ép sejtekben nem. A legtöbb álnegatív minta esetében tehát a nem daganatos sejtek DNS-e mintegy "elnyomja" a daganatos sejtek mutáns DNS-ét.
A szenzitivitás javításának egyik - hazánkban is gyakran alkalmazott - módja, hogy a mintában előforduló mutáns DNS szálakat biokémiai módszerekkel feldúsítják, ami azonban a szelektivitás csökkenéséhez, tehát álpozitív eredmények megjelenéséhez vezethet.
Létezik azonban egy másik módszer is a szenzitivitás javítására, a lézer katapult mikrodisszekció (LPCM). A módszer lényege, hogy a daganatos sejteket mikroszkóppal kijelölve lézernyalábbal juttatják őket a reakciócsőbe, így kizárólag a daganatból származó DNS-t vizsgálják a továbbiakban. Az LPCM és a Sanger-szekvenálás együttes használatával megvalósítható, hogy a szenzitivitás és a szelektivitás egyszerre legyen 100%-os. Az LPCM elterjedését a rutin diagnosztikában gátolja a módszer nagy munkaigénye, ami a lézerrel szeparált daganatsejtek számával arányos. A KPS Molekuláris Diagnosztikai Központban a vizsgálathoz szükséges daganatsejtek számát nagy szenzitivitású molekuláris biológiai módszerek kifejlesztésével sikerült csökkenteni, lehetővé téve az LPCM-et követő Sanger-szekvenálás rutin diagnosztikai alkalmazását. Ez diagnosztikai módszer vizsgázott most jelesre a nemzetközi megmérettetésben.
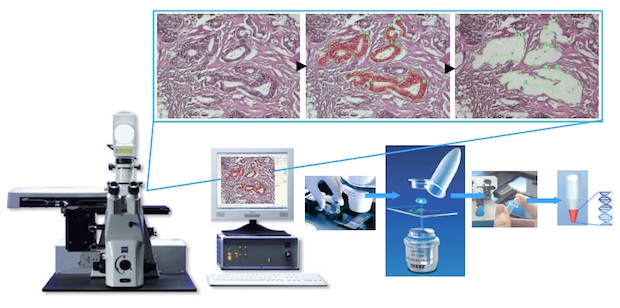
A lézer katapult mikrodisszekció (Forrás: KPS)
TheraScreen készlet (Forrás: Roche)
* * *
Tisztelt Olvasónk! Felhívjuk a figyelmét, hogy anyagaink tájékoztató és ismeretterjesztő jellegűek, így nem adhatnak választ minden olyan kérdésre, amely egy adott betegséggel vagy más témával kapcsolatban felmerülhet, és főképp nem pótolhatják az orvosokkal, gyógyszerészekkel vagy más egészségügyi szakemberekkel való személyes találkozást, beszélgetést és gondos kivizsgálást.