2010 végéig több száz egyedi daganattípus teljes genetikai állományát fogják megfejteni a szakemberek. A következő években ez a szám 25 000-re fog nőni: a kérdés ezután már nem az lesz, hogy milyen mutációk fordulnak elő a tumorokban, hanem hogy pontosan milyen változásokat okoznak a felfedezett DNS-hibák. Ennek megválaszolása az igazán nehéz feladat, de már a rákkal összefüggő mutációk teljes feltárása is hatalmas lépés a rákkutatás számára.
Onkológiai diagnosztikai hírek:
A magyar Oncompass Medicine a Fehér Ház partnere lett a rák ellenes harcban
Daganatot jelezhet-e a nyaki nyirokcsomók duzzanata?
Magyar résztvevője is lesz a mesterséges intelligencia hasznosításáról szóló washingtoni csúcstalálkozónak
Képalkotó vizsgálatok, amikre készülni kell. De hogyan?
Háttéranyag
Évtizedek óta ismert, hogy a rák egy genetikai eredetű betegség: a daganatos elfajulások hátterében minden esetben a sejtek DNS-állományában fellépő változások húzódnak meg. A mutációk idővel felhalmozódnak, és különféle súlyosságú betegséget alakítanak ki. Mára számos olyan DNS-szakaszt (gént) sikerült azonosítani, amelyek egyértelműen összefüggésbe hozhatóak a daganatok kialakulásával, a hatékony kezeléshez ez azonban korántsem elegendő. Az utóbbi években emiatt már nem az egyedi rákkeltő gének megtalálása, hanem a különféle ráktípusok teljes genetikai állományának (genomjának) leírása volt a fő cél. Ez lesz ugyanis az alapja annak, hogy egy nap teljes képet kaphassunk az egyedi tumorok kialakulásáról, és ezen keresztül nyílhat lehetőség a mostaniaknál jóval hatékonyabb, személyre szabott kezelési eljárások kifejlesztésére is.
A rákkal összefüggő összes lehetséges mutáció azonosítása még nem fejeződött be, ez azonban hamarosan megtörténik: 2010 végére várható, hogy nemcsak néhány, hanem több száz egyedi rákgenom teljes bázissorrendje (szekvenciája) is teljesen ismert lesz a kutatók előtt. Pár éven belül pedig már mintegy 25 000 tumorminta genomszekvenciáját deríthetik fel, adatokból tehát egészen biztosan nem lesz hiány a közeljövőben.
Tű a szénakazalban
Miért lényeges, hogy ne csak néhány fontos mutációt, hanem a tumorokra jellemző összes lehetséges DNS-hibát is megismerjük? A teljes genomanalízis fontosságát jól szemlélteti az IDH1 nevű gén rákkal összefüggő szerepének megismerése. A gén mutációját 2006-ban azonosították egy vastagbélrákkal kapcsolatos vizsgálat során, ennek azonban nem sok jelentőséget tulajdonítottak. Az újonnan felfedezett génmutáció a harmincöt vizsgált tumorból csak egyben volt jelen, és további 300 tumorminta elemzése során sem sikerült azonosítani a gén egyetlen más mutációját sem. Kiderült, hogy a mutáció mindössze egyetlen bázis megváltozásáért tehető felelőssé a génben (ezek az úgynevezett pontmutációk). Mivel a kutatás során vizsgált 13 000 génben számos egyéb mutációt sikerült azonosítani, senki sem gondolta, hogy az IDH1-nek fontos szerepe lehet a rák kialakulásában.
A DNS-vizsgálatok bővülésével azonban nem várt eredmények derültek ki. Az anyagcsere egyik enzimjét előállító IDH1 mutációja máshol is felbukkant: a rosszindulatú agydaganatokból vett minták 12%-ában, emellett a leukémiás minták 8%-ában sikerült azonosítani a gén hibás változatait. A kutatásokból időközben kiderült, hogy az említett mutáció hatására jelentősen megváltozik a gén által kódolt enzim aktivitása: a sejtekben a daganatok kialakulását elősegítő anyagcseretermékek kezdenek el felhalmozódni.
Négy évvel az IDH1 mutáció felfedezését követően már egyetlen rákkutató sem vitatja, hogy miért fontosak a tumorok teljes genetikai állományát vizsgáló kutatások. Többen ezt a génmutációt szokták említeni annak példájaként is, hogy a modern genomelemző módszerekkel miként lehetséges megtalálni a tűt a szénakazalban - írja Heidi Ledford a Nature News összefoglalójában.
Pillanatfelvétel a genomról
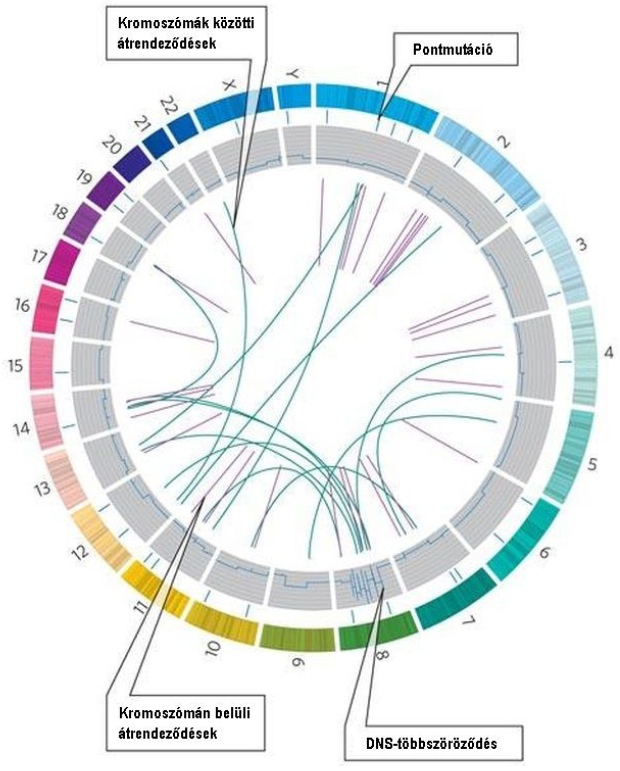
Az ábrán a rákos sejt genetikai állományában található összes mutáció látható. A kör külső gyűrűje a kromoszómákat jelképezi (22 pár testi és két ivari kromoszóma). A belső gyűrűk a különböző típusú mutációk kromoszómán belüli elhelyezkedését mutatják.
Négy daganattípusnál már kész a teljes genomszekvencia
Az elmúlt két évben kezdődtek meg azok a kutatások, amelyekben több száz egyedi tumor DNS-ének bázissorrendjeit kezdték el meghatározni. Ezekben a vizsgálatokban a tumorsejtek genetikai állományát a betegekből származó egészséges sejtek DNS-ével hasonlítják össze: mindez lehetővé teszi, hogy minden tumor esetében külön-külön is megállapítsák az adott daganatra és tumortípusra sajátságosan jellemző genetikai eltéréseket. Körülbelül 75 rákgenom részleges elemzése már jelenleg is elérhető, 2010 végéig pedig több száz további tumor genetikai állományának készülhet el a teljes bázissorrendje. Jelenleg a tüdőrák kissejtes típusánál, az áttéteket képző bőrráknál (melanoma), valamint az emlőrák és a leukémia egy-egy fajtájánál érhető el a teljes genom DNS-szekvenciája.
Néhány példa az eddig elkészült rákgenomok közül, azok legfontosabb adataival:
| Ráktípus | Eredmények | Kiemelt eredmény |
|---|---|---|
| Kissejtes tüdőrák | - Teljes genom - Pontmutációk száma: 22 910 - Génszakaszokra eső pontmutációk: 134 darab - A genomon belüli DNS-átrendeződések: 58 - DNS-többszöröződések száma: 334 |
A CHD7 gén megkettőződését két másik kissejtes tüdőrák sejtvonalban is megerősítették. |
| Áttétes melanoma | - Teljes genom - Pontmutációk száma: 33 345 - Génszakaszokra eső pontmutációk: 292 darab - A genomon belüli DNS-átrendeződések: 51 - DNS-többszöröződések száma: 41 |
A mutációk mintázata megfelel az UV-sugárzás által okozott károsodásnak. |
| Bazális emlőrák | - Teljes genom - Pontmutációk száma: 27 173 - Génszakaszokra eső pontmutációk: 200 darab - A genomon belüli DNS-átrendeződések: 34 - DNS-többszöröződések száma: 155 |
A CTNNA1 gén fehérjéje gátolhatja az áttétképződést: a gén törlődött a ráksejtekben |
| Glioblasztóma multiforme | - Csak a genom egy része (génszakaszok) - Azok a gének, amelyek legalább egy, fehérjét is befolyásoló mutációt tartalmaznak: 685 - Azok a gének, amelyek legalább egy, fehérjét is befolyásoló pontmutációt tartalmaznak: 644 - DNS-többszöröződések száma: 281 |
Az IDH1 gén aktív részén a betegek 12%-ában voltak jelen mutációk |
A tüdőrák és a melanoma genomvizsgálatának külön érdekessége, hogy a daganatok jól ismert kiváltó okait is sikerült hozzárendelni a megfigyelt mutációkhoz. A tüdődaganatban megfigyelt DNS-hibák egyértelmű összefüggést mutattak a dohányfüstben található több mint hatvanféle rákkeltő anyaggal: ezek a vegyületek éppen olyan károsodásokat okoznak az örökítőanyagban, mint amit a mintákban is megfigyeltek. Ebből pedig az is következik, hogy a dohányzás elhagyásával valóban megelőzhető lenne a vizsgálatban megfigyelt mutációk nagy részének kialakulása.
A melanomasejtekben megfigyelt mutációknál - a dohányfüsthöz hasonlóan - többnél is be lehetett azonosítani a bőrdaganatok leggyakoribb kiváltó okának, az UV-sugárzásnak a korábbi jelenlétét. A daganatsejt DNS-ének bázissorrendjéből egyértelműen vissza lehetett következtetni a rák kialakulásának történetére: azonosíthatóak voltak azok a korai mutációk, amelyek az UV-sugárzás következtében alakultak ki, és azok is, amelyek a melanoma későbbi áttétképződése során jelenhettek meg. Ezek alapján is érdemes tehát megfogadnunk azokat a tanácsokat, amelyek a melanoma megelőzése érdekében nem javasolják a túlzásba vitt napozást és szoláriumozást.
Az élőlények örökítőanyagának, azaz a DNS-nek az információkódoló részét négy "betű" (azaz négy úgynevezett nukleotid) adja. Ez a négy betű az A (adenin), T (timin), G (guanin) és C (citozin). E betűk hosszú sorából (emberben körülbelül 3 milliárd) áll a genetikai állomány, a genomszekvenálás pedig a nukleotidok sorrendjének meghatározását jelenti a teljes örökítőanyagban.
Fontos tudni, hogy a kutatók sokáig csak a DNS-állomány fehérjéket kódoló részének szerepét vizsgálták, ami viszont a teljes örökítőanyagnak csupán 1-2 százalékát teszi ki az ember esetében. A sokáig elhanyagolt "maradékról" (amely pontosabban a genom 98,7%-át alkotja) az elmúlt néhány év során bizonyosodott be, hogy például a génszabályozásban, illetve a genom stabilitásának megőrzésében tölt be nélkülözhetetlen szerepet.
Mit kezdünk majd a sok adattal?
A genomszintű felmérések első fontosabb eredményei tehát már megvannak, néhány év múlva pedig mintegy ötvenféle tumortípus mutációs adataival rendelkezhetnek majd a kutatók (lásd a Nemzetközi Rákgenom Konzorciumról szóló keretes anyagunkat). Ez azonban nem azt jelenti, hogy minden egyszerűbb lesz, hanem éppen ellenkezőleg, még összetettebbé válik majd az eddigi kép. Hogyan lehet majd a hirtelen rendelkezésre álló információtömeget a rákbetegek szempontjából is értékelhető módon felhasználni.
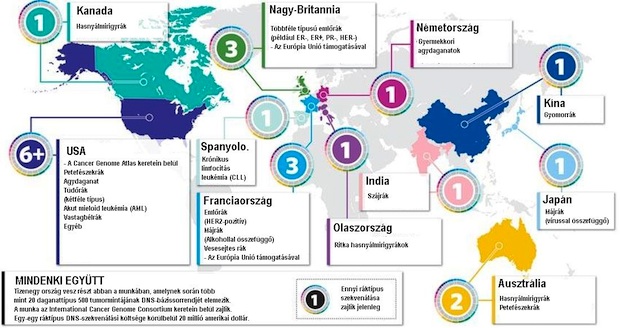
A fenti térkép azokat az országokat mutatja, amelyek a Nemzetközi Rákgenom Konzorcium irányításával jelenleg részt vesznek a különféle ráktípusok genomelemzésében.
A kép megnyitása nagyobb méretben
A központi nehézséget egyértelműen az fogja jelenteni, hogy a nagy mennyiségű pontmutációt és az örökítőanyag egyéb eltéréseit (ismétlődő, törlődött, felcserélődött és megkettőződött DNS-szakaszok) ne csak rendszerezzék, hanem a betegek kezelésében is hasznosítsák. Elsőként azt kell meghatározni, hogy melyek azok a mutációk, amelyek konkrét okozói vagy gyorsítói a rákos elváltozások kialakulásának, és melyek azok, amelyek a rák vagy a DNS hibajavító mechanizmusainak károsodása következtében alakultak ki (a kétféle mutációtípusról kapcsolódó háttéranyagunkban olvashatnak részletesebben). Később aztán - és ez lesz az igazán nehéz feladat - az azonosított mutációk pontos funkcióit is tisztázni kell.
"Az új adatok orvosi gyakorlatba történő átültetéséhez a mostaninál sokkal kifinomultabb klinikai vizsgálatokra lesz szükség. Ezekben már azt is figyelembe kell venni, hogy a tumoroknak sokkal többféle altípusa létezik, mint amiről eddig tudtunk. A ráksejtek genetikai állományának vizsgálata egyre olcsóbb lesz, így a nem túl távoli jövőben talán lehetővé válhat, hogy a daganatos betegek mindennapi kezelésében is felhasználják a teljes vagy részleges rákgenomokat" - írják a Nemzetközi Rákgenom Konzorcium kutatói a Nature nemrégiben megjelent számában.
Mivel a rák kialakulása szorosan összefügg a mutációk kialakulásával és felhalmozódásával, az egyes ráktípusok genetikai állományának feltérképezését is a Humán Genom Program mintája alapján szervezték meg. Az ember genetikai állományát feltáró Humán Genom Programban is több intézmény vett részt, és ez ugyanígy zajlik a rákgenom-elemzéseknél is. A kutatásokat a 2008-ban alapított Nemzetközi Rákgenom Konzorcium (International Cancer Genome Consortium; ICGC) hangolja össze: a program keretein belül a következő években összesen ötvenféle ráktípus 500-500 tumormintáját szeretnék megvizsgálni (a munka jelenleg 11 országban zajlik összesen húszféle daganattípuson, részletesen lásd térképünkön). A 25 000 teljes rákgenomot eredményező munka teljes költsége a becslések szerint akár az egymilliárd amerikai dollárt is elérheti majd.
A Nemzetközi Rákgenom Konzorcium részeként működik két régebben indított, hosszú távú program is: az egyik a Cambridge-i Wellcome Trust Sanger Institute-ban folyó Rákgenom Projekt (Cancer Genome Project), a másik pedig az amerikai Nemzeti Egészség Intézetek (NIH) által koordinált Rákgenom Atlasz (Cancer Genome Atlas; TCGA). A Rákgenom Projekt keretein belül már eddig is több mint száz tumorminta részleges genomelemzését végezték el, a következő 5-7 évben pedig 2-3000 további minta teljes genomvizsgálatát tervezik. A Rákgenom Atlasz kutatói a következő öt évben húszféle ráktípus 500 tumormintájában fogják feltárni a rákos sejtek DNS-ének teljes bázissorrendjét - írja a Nature News.
Fordította: Illyés András
Olvassa el részletes háttéranyagunkat a mutációk kialakulásáról:
Hogyan alakulnak ki szervezetünkben a mutációk?
A rosszindulatú rákos elfajulások hátterében minden esetben a sejtek DNS-állományában fellépő változások, szakszóval a mutációk felhalmozódása húzódik meg. Az utóbbi negyed évszázad során a rákkutatás középpontját ezeknek a genetikai módosulásoknak a feltérképezése jelentette. Hogyan alakulnak ki szervezetünk mutációi?
Tisztelt Olvasónk! Felhívjuk a figyelmét, hogy anyagaink tájékoztató és ismeretterjesztő jellegűek, így nem adhatnak választ minden olyan kérdésre, amely egy adott betegséggel vagy más témával kapcsolatban felmerülhet, és főképp nem pótolhatják az orvosokkal, gyógyszerészekkel vagy más egészségügyi szakemberekkel való személyes találkozást, beszélgetést és gondos kivizsgálást.