A meghibásodott RAS fehérjék a rákok egyharmadában irányítják a növekedést, működésüket azonban még nem sikerült gyógyszeres úton gátolni
A meghibásodott RAS fehérjék a rákok egyharmadában irányítják a növekedést, működésüket azonban még nem sikerült gyógyszeres úton gátolniNemrégiben hozták nyilvánosságra, hogy az USA-beli Nemzeti Rákkutató Intézet (National Cancer Institute) "megaprojektet" indítana, ami új megközelítést ígér a rákkutatásban. A program egy RAS nevű fehérjecsaládra koncentrál, mely fehérjék a sejtek növekedéséhez és túléléséhez szükséges sejtbéli jeleket továbbítják. Az amerikai szervezet által meghirdetett projekt azért különleges, mert több száz, ezzel a témával foglalkozó kutatót vonna be, hogy együtt dolgozzanak a meghibásodott RAS fehérjék gátlásán, melyek a rákok egyharmadában irányítják a növekedést.
Vastagbélrák hírek:
A végbélrák célzott terápiájának legújabb eredményei
Az otthoni vastagbéltükrözés hatékonyságát méri fel egy új klinikai vizsgálat
Vastagbélrák: hogyan igényelhető ingyenes, elsőbbségi genetikai teszt?
A vastagbélrák sokféle, így is kell kezelni
Háttéranyagok:
"A gyógyszercégek régen lemondtak a RAS blokkolásáról, mivel nem rendelkezik olyan egyértelmű "zsebbel" vagy kötőhellyel, amelybe a gyógyszermolekulák kötődni tudnának" - közölte Frank McCormick, a projekt vezetője. Azonban mostanában a kutatók gyenge pontokat találtak a RAS-on, és az NCI úgy gondolja, itt az ideje egy koordinált támadásnak.
A projekt során központi laborok biztosítanák a kutatáshoz szükséges sejtvonalakat, egereket és monoklonáris antitesteket. A projekt egy szellemi közösséget ígér, például olyan módon, hogy elhelyeznének egy problémát egy weboldalon, és meghívnák a tudományos közösséget, hogy kommentálja. Olyan kutatókat is vonzhat a kezdeményezés, akik egyébként nem foglalkoznának a témával, mert túl régi, vagy mert nem várható az eredmények legjobb folyóiratokban való megjelentetése, mint a Nature vagy a Science.
Hogyan és miért alakul ki a rák?
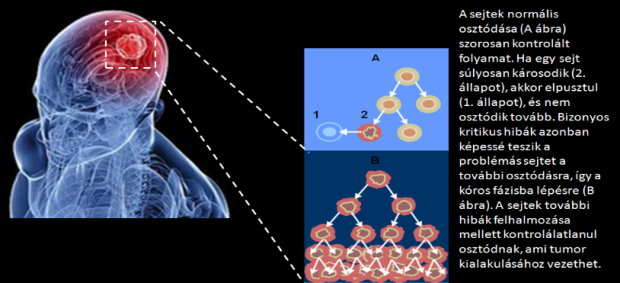
Ahhoz, hogy megértsük, tulajdonképpen miért is fontos a sejtnövekedési jelek továbbítása a rák kialakulásában, át kell tekintenünk a rák kialakulásának folyamatát.
A rák tulajdonképpen a sejtek szabályozatlan szaporodását jelenti, mely szaporulat később betörhet más szövetekbe és áttétet képezhet. Bizonyos gének (olyan DNS-szakaszok, melyek információtartalma fehérjét ír le) a DNS meghibásodása miatt onkogénné válhatnak. Ez azt jelenti, hogy a belőlük kialakuló, meghibásodott vagy megnövekedett mennyiségű fehérje elősegíti ezt a szabályozatlan osztódást.
Onkogénnek nevezzük a meghibásodott génből létrejött fehérjét is, de más, a sejten kívülről érkező, osztódást "elszabadító" molekulákat is (eredetileg vírusok DNS-ét). Proto-onkogén névvel azt a gént illetjük, amelyből az onkogén kialakul. Génjeink túlnyomó részéből apai és anyai kromoszómánkon is hordozunk egy változatot, és az onkogének esetében elég az egyiknek meghibásodnia, viszont onkogén létrejötte nélkül nincs rák.
A kép nagyobb méretben (Forrás: Wikipedia)
Az onkogének hatásával ellentétesen működnek a tumorszupresszorok: ezek például javítják a DNS-hibákat, gátolják a sejtosztódást, vagy programozott sejthalált indítanak be. A sejthalál még az osztódás előtt kiiktathatja a hibás sejtet, illetve csökkenti a sejtszaporulatot. A tumorszupresszorok működésének megszűnéséhez mindkét kromoszómán levő példánynak tönkre kell mennie.
A rák kialakulása során tulajdonképpen hibák felhalmozódásáról beszélhetünk. A sejtciklus, vagyis a sejtek növekedése, DNS-ük megkettőződése és osztódásuk szigorú szabályzás alatt áll. Több hibának kell kialakulnia, hogy egy sejt kiszabaduljon a - sokszor tartalékrendszerekkel ellátott - ellenőrzés alól. Ez legalább egy onkogén kialakulását és legtöbbször minimum három tumorszupresszor tönkremenetelét (mindkét kópia) jelenti.
Azonban, a hibák felhalmozása egyre gyorsabb, mivel például egyes tumorszupresszorok pont a DNS hibáit javítják. A DNS-hibák javításának megszűnése pedig további hibák felhalmozását, onkogén kialakulását vagy tumorszupresszor meghibásodását okozhatja. Ahogy a hibás sejtek osztódnak, és még inkább meghibásodnak, egyre többféle sejt alakul ki a tumorban, melyek különbözősége tovább nehezíti a gyógyítást.
A jövőben talán a hibás KRAS fehérje is támadhatóvá válhat
A most célpontként kijelölt RAS fehérjék tehát onkogénné válhatnak, és ezután a sejtnek a folyamatos osztódásra adnak utasítást.
"Miután a RAS fehérjékről 30 éve tudjuk, milyen fontos szerepük van a rák kialakulásában, végre születhet olyan eredmény, amely a páciensek számára segítséget tud nyújtani" - fogalmazott Harold Varmus, az NCI igazgatója. A kutatást csupán 10 millió dollárból finanszíroznák, melyet az NCI más projektjeiből csoportosítanak át, mégis úgy tűnik, hogy a történetének talán legkomolyabb finanszírozási válságával küzdő NCI új kezdeményezéseknek is helyet ad.
A KRAS elromlása - több más ráktípus, például a tüdőrák mellett - a vastagbélrákok jelentős részében is szerepet játszik. A rák kontrollálatlan sejtszaporulata egy olyan többlet, mely akkor jön létre, ha felbomlik a szaporodásra gerjesztő jelek és a pusztulásra felszólító jelek egyensúlya. A KRAS egy ilyen szaporodásra való felszólítást küld a sejt számára, amely az EGFR receptor által leadott jelből jön létre.
A vastagbélrákok kezelhetetlenségének gyakori oka, hogy hiába gátoljuk az EGFR jel képzését, ha a hibás KRAS magától is elküldi a szaporodásra buzdító jelet. Ha gátolni tudnánk a hibás KRAS-t, leállítható lenne a szaporodás, akkor is, ha a KRAS magától küldi a jeleket, nem az EGFR hatására.
A projektet öt részletre osztották. Az első a KRAS fehérjének, a család leggyakoribb tagjának szerkezetét derítené fel a sejtbeli molekulákkal való reakcióiban. A második feladat a KRAS blokkolás új stratégiáinak kifejlesztése lenne. A következő képalkotó és screening technikákkal tárná fel és szétrombolná a KRAS sejtbéli komplexeit. A negyedik feltérképezné a megváltozott RAS-t tartalmazó sejtek felszínén található fehérjéket és peptideket, mivel így ezek a sejtek támadhatóak lennének antitestekkel és nanorészecskékkel. Végül feltárnák azon fehérjék kombinációit, melyek a megváltozott RAS fehérjéket tartalmazó ráksejtek túléléséhez járulnak hozzá.
A projektet támogatták a döntéshozók, és remélhetőleg további, nehezen támadható molekulák is célkeresztbe fognak kerülni a későbbiekben. A gyógyszerek fejlesztése ugyanis legtöbbször úgy működik, hogy kiválasztják azokat a molekulákat, amelyek központi szerepet töltenek be egy betegség kialakulásában. A rák esetén ezek onkogének, tumorszupresszorok. Ezután megpróbálnak olyan molekulákat kifejleszteni, amelyek hozzájuk kapcsolódva pozitív irányba terelik a működésüket.
Ennek kiindulási alapja, hogy ismerve a célzott molekula térbeli kinézetét, azokra a helyekre illesztik a gyógyszert, ahol más molekulákhoz szokott kötődni. Ezek látszanak zsebként, kötőhelyként a térszerkezeten. A nehezen támadható kifejezés gyakran azt jelenti, hogy nem egyértelmű ez a támadási hely - ez a probléma áll fenn például a RAS esetében is.
Kocsis Zsuzsa
ELTE-MTA "Lendület" Motorenzimológiai Kutatócsoport
* * *
Kocsis Zsuzsa munkája a TÁMOP 4.2.4.A/1-11-1-2012-0001 azonosító számú Nemzeti Kiválóság Program - Hazai hallgatói, illetve kutatói személyi támogatást biztosító rendszer kidolgozása és működtetése országos program című kiemelt projekt keretében zajlott. A projekt az Európai Unió támogatásával, az Európai Szociális Alap társfinanszírozásával valósul meg.
Tisztelt Olvasónk! Felhívjuk a figyelmét, hogy anyagaink tájékoztató és ismeretterjesztő jellegűek, így nem adhatnak választ minden olyan kérdésre, amely egy adott betegséggel vagy más témával kapcsolatban felmerülhet, és főképp nem pótolhatják az orvosokkal, gyógyszerészekkel vagy más egészségügyi szakemberekkel való személyes találkozást, beszélgetést és gondos kivizsgálást.