A krónikus mieloid leukémia egy ritka, lassú előrehaladással jellemezhető vérképzőszervi betegség. A kórkép előrehaladása ma már pontosan ellenőrizhető molekuláris diagnosztikai vizsgálatokkal, a kezelés pedig többféle célzott szerrel is lehetséges. Elsővonalbeli kezelésként mindig ugyanazt a szert adják, ha azonban ez nem bizonyul kellően hatékonynak, emelni lehet a dózist vagy újabb szerekre lehet váltani.
Mi a krónikus mieloid leukémia (CML)?
A fehérvérűség (leukémia) a csontvelő éretlen vérképző sejtjeinek rákos elfajulása következtében alakul ki. A daganatossá vált sejtek felszaporodnak, és a legtöbbször a vérben is megjelennek. A leukémiának két fő típusát, az úgynevezett mieloid és limfoid formáját különítik el. A fehérvérsejtek a csontvelő őssejtjeiből keletkeznek, az elkülönítés pedig az alapján történik, hogy a rákos elfajulás a mieloid vagy a limfoid típusú őssejteket érintette-e.
A leukémiának egy további felosztása is létezik az alapján, hogy a megbetegedés milyen gyorsan lép fel és milyen gyorsan zajlik le. Eszerint is kétféle típust különböztetünk meg, az akut és a krónikus leukémiát. Az akut forma általában sokkal gyorsabban zajlik le, mint a krónikus típus. A krónikus mieloid leukémia tehát olyan fehérvérűséget jelent, amely krónikus (lassabb) lefolyású, és a fehérvérsejteket létrehozó őssejtek mieloid típusát érinti. A betegséget - a daganat angol elnevezéséből, Chronic Myeloid Leukemia - CML-ként szokás rövidíteni.
A leukémiának 3 további típusa ismert, ezekről a leukémia háttéranyagunkban olvashatnak bővebben.
A CML előfordulása
A CML egy viszonylag ritka ráktípus. 100 000 emberből világszerte és évente egy-két új esetet diagnosztizálnak. A CML általában a középkorú és az idősebb korosztályt érinti: a betegség diagnózisának átlagos életkora az 55 és a 60 év közé esik. A CML ennek ellenére a gyermekeknél és a fiatalabb generációban is előfordulhat: az összes eset nagyjából 2 százalékát diagnosztizálják gyermekeknél. A CML valamivel gyakrabban érinti a férfiakat, mint a nőket, ennek azonban egyelőre nem ismertek az okai.
A CML tünetei
A CML előrehaladása általában igen lassú, ezért a korai stádiumban nehéz felismerni. Ez sokszor csak véletlenül történik meg, olyankor, ha a betegnél más okból végeznek vérvizsgálatot (négyből átlagosan egy betegre jellemző, hogy a betegség hosszabb időn keresztül semmilyen tünetet sem okoz). A CML jellemző tüneteit a nagyszámú kóros fehérvérsejt jelenléte és a normális vérsejtek csökkent ütemű termelődése okozza. A CML tünetei eleinte enyhék, és csak később, a betegség előrehaladásával válnak súlyosabbá.
A CML egyszerű influenzaszerű tünetekkel is kezdődhet. Sajnos a többi tünet sem kifejezetten csak a CML-re jellemző, így a legtöbb esetben ezeket más kórképek okozzák. A CML-re az alábbi tünetek a jellemzőek:
- Hasi panaszok, amelyek a lép gyulladása és megnagyobbodása miatt jelenhetnek meg
- El nem múló fáradtság, ami a vörösvérsejtek alacsony száma miatt alakul ki
- Testsúlycsökkenés, étvágytalanság
- Fejfájás és látászavarok
- Éjszakai izzadás és láz (a betegség korai fázisában ez nem jellemző)
- Csontfájdalom
- Férfiaknál fájdalmas merevedés, amely később sem szűnik meg
A CML jellemzően a krónikus fázissal kezdődik, majd ahogy a betegség előrehaladása felgyorsul, fokozatosan akuttá válhat (ezt nevezik felgyorsult fázisnak). A CML legutolsó fázisa az úgynevezett blasztos krízis, amely már súlyos tüneteket okoz. Szerencsés esetben azonban még ez is kezelhető lehet.
A CML kialakulásának kockázati tényezői
Tipikus, csak a CML-hez rendelhető kockázati faktorok nincsenek, néhány tényező azonban kismértékben növelheti a betegség kialakulásának kockázatát. Ilyen például az életkor: ahogy idősödünk, kissé növekszik a CML megjelenésének esélye. Mivel egy ritka ráktípusról van szó, ez a kockázatnövekedés igen enyhe.
Ha egy másik ráktípus jelenléte miatt korábban már kaptunk sugárkezelést, akkor szintén növekedhet a CML kockázata. Itt is csak enyhe kockázatnövekedésről van szó.
Ha valakinek legyengült az immunrendszere - például szervátültetésen esett át vagy HIV-fertőzötté vált - akkor szintén nagyobb eséllyel alakulhat ki a betegség. A bél hosszú időn át tartó gyulladása (fekélyes vastagbélgyulladás) szintén növeli a CML megjelenésének esélyét. Egy további, igen enyhe kockázatnövelő tényező a jelentős túlsúly megléte.
A CML szűrése
A CML korai felismerésére nem létezik népegészségügyi szűrőprogram. Ennek oka, hogy maga a leukémia sem egy gyakori megbetegedés, a CML pedig különösen nem az. Szűrőprogramot kizárólag abban az esetben lehetne a CML-re is bevezetni, ha a teszt egyszerű, gyors és olcsón kivitelezhető lenne, ilyen azonban jelenleg nem létezik.
A CML szűrése abban az esetben lehetne költséghatékonyan is kivitelezhető, ha eleve csak azokat tesztelnék, akiknél genetikai okokból magasabb eséllyel jelenhet meg a betegség. Jelenleg azonban még nem lehet előre megmondani, hogy pontosan kik tartoznak a magasabb kockázatú csoportba. Az úgynevezett Philadelphia-kromoszóma hibája ismert ugyan a CML-es betegeknél, ez azonban önmagában nem nevezhető kockázati tényezőnek: a kromoszóma-eltérés nem örökölhető, és a gyermekeinknek sem adhatjuk tovább. A betegséget egy kromoszóma-átrendeződéssel járó mutáció megjelenése okozza, amely azonban minden előzmény nélkül kialakulhat (részletesen lásd lejjebb, a CML genetikai okainál).
A CML diagnosztikája
Az első vizsgálat legtöbbször a háziorvosnál zajlik, aki különféle okokból vérvizsgálatot javasolhat - a CML-re sokszor ezt követően derül fény. Ha felmerül a krónikus mieloid leukémia gyanúja, háziorvosunk hematológus szakemberhez irányít minket. A speciálisabb tesztek elvégzésére itt kerül sor. Ezek között szerepel az ismételt vérvétel, a csontvelő-mintavétel, továbbá a röntgenes és ultrahangos vizsgálat. A betegségre jellemző kromoszóma-eltérést a betegek nagyjából 95%-ánál lehet kimutatni a csontvelőből vett sejteken.
A CML genetikai okai
A CML genetikai okai ma már igen jól ismertek. A 22-es kromoszóma hossza a CML-es betegeknél lerövidül, amelyet ebben a formájában Philadelphia-kromoszómának neveznek. (Az elnevezés onnan származik, hogy a genetikai rendellenességet elsőként Philadelphiában írták le, 1960-ban).
A 22-es kromoszóma azáltal rövidül le, hogy genetikai anyagának egy része átkerül a 9-es kromoszómára, amely így meghosszabbodik. Emellett egy másik változás is lezajlik: nem csak a 22-es kromoszóma ad DNS-t a 9-es kromoszómának, hanem a 9-es is a 22-esnek. A csere során a 9-es kromoszóma "Abl" jelzésű szakasza kerül át a 22-es kromoszómára, méghozzá a "Bcr" jelzésű szakasz alá (genetikai szaknyelven ezt nevezik transzlokációnak, lásd az alábbi ábrán).
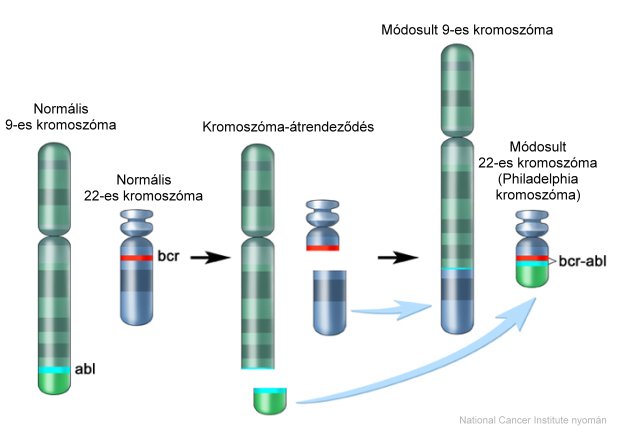
A Philadelphia kromoszóma kialakulása - a kromoszóma-átrendeződés a 9-es és a 22-es kromoszóma között megy végbe. Philadelphia kromoszómának a megrövidült 22-es kromoszómát nevezik. Ez a hiba a felelős a CML kialakulásáért, a mutáció miatt ugyanis rendellenes tirozin-kináz enzim kezd termelődni.
A problémát a 22-es kromoszómán így létrejött DNS-szakasz okozza, amelyet a "Bcr-Abl" elnevezéssel jelölnek. A 22-es kromoszóma megváltozott szakasza ugyanis egy rendellenesen működő enzimet hoz létre (Bcr-Abl tirozin-kináz), amely folyamatosan arra serkenti a szervezetet, hogy mieloid típusú fehérvérsejt-előalakokat termeljen.
Ezen alapul a betegség célzott kezelése is, amelynek során kifejezetten a meghibásodott enzimet gátolják tirozin-kináz gátló szerekkel.
A CML modern kezelése
A CML-t korábban kemoterápiával, interferon-kezeléssel, illetve csontvelő-átültetéssel kezelték. Külföldön 2001-ben, hazánkban pedig 2002-ben törzskönyvezték az első olyan szert, amellyel már célzottan (a hibás enzim gátlásával) kezelhetőek a betegek. Az enzimgátló hatóanyag megjelenése radikálisan megváltoztatta a CML kezelésének menetét.
A gyógyszer a 22-es kromoszóma hibája miatt abnormális formában termelődő tirozin-kináz enzimre hat. A terápia fő célja, hogy a csontvelőből sikerüljön eltüntetni azokat a sejteket, amelyek a mutáción átesett 22-es kromoszómát hordozzák. Ha ez sikerül, akkor beszélünk teljes citogenetikai válaszról (complete cytogenetic response; CCR). A betegség ilyenkor maradvány, idegen szóval reziduális formában lehet jelen, amit viszont kizárólag molekuláris vizsgálatokkal lehet kimutatni. Erre az állapotra vezettek be egy új kifejezést, a teljes molekuláris remissziót, angolul Major Molecular Remission; MMR.
A célzott terápia sikeressége azon mérhető le, hogy megjelenik-e a teljes citogenetikai válasz, kialakul-e a teljes molekuláris remisszió, és kitolódik-e a beteg tünetmentes túlélése. A molekuláris vizsgálatok elvégzéséhez a megfelelő felszereltségű laborokra is szükség van, ami már hazánkban is rendelkezésre áll (lásd korábbi anyagunkat: Egyedülálló betegregiszter készül a krónikus myeloid leukémiában szenvedőknek).
Véglegesen sajnos még a célzott terápiák sem gyógyítják meg a betegeket, segítségükkel azonban kontrollálhatóak a CML tünetei, lecsökkenthető a kóros fehérvérsejtszám, és megelőzhető a betegség végső fázisba történő előrehaladása. Az egyik, hosszú távon végzett klinikai vizsgálat szerint az elsővonalbeli célzott kezeléssel a betegek 86%-a (vagyis tízből átlagosan kilenc beteg) maradt életben hét évvel azután, hogy megkezdték nála a kezelést. Egy másik vizsgálat azt is kimutatta, hogy az elsővonalbeli célzott kezelésben részesülő betegek 87%-ánál sikerült elérni a teljes citogenetikai választ.
Az Európai Leukémia Hálózat (European LeukemiaNet) szakemberei - a fenti eredmények alapján - ma már általánosan javasolják, hogy a betegség állapotmonitorozása ne az egyszerű tünetmentesség, hanem a teljes citogenetikai válasz és a molekuláris remisszió együttes igazolása alapján történjen.
Milyen adagban javasolt a célzott szer és kialakulhat-e rezisztencia?
A frissen felfedezett CML betegek 65-70%-ánál napi 400 milligramm célzott hatóanyag szedése javasolt. Amennyiben a kezelés kezdete után a vérkép, valamint a citogenetikai és a molekuláris vizsgálatok eredményei is a várt módon alakulnak, akkor nincs ok a gyógyszer napi adagolásának megváltoztatására. A felgyorsult vagy a blasztos fázis megjelenési esélye ebben az esetben mindössze néhány százalékos marad.
Sajnos az is előfordulhat - a betegek körülbelül 35-40%-ánál - hogy a páciens rezisztenssé válik a nála addig hatékonyan működő célzott kezelésre. A gyakoribb eset, hogy a rezisztencia egy hosszabb vagy rövidebb, de sikeresnek mondható kezelési időszak után alakul ki. A sikertelenségre a vérkép, illetve a már említett citogenetikai és molekuláris genetikai vizsgálatok hívják fel a figyelmet (a Philadelphia-kromoszómát hordozó sejtek ekkor újra megjelennek a csontvelőben).
A kezelés eredménytelensége esetén kétféle lehetőség adódik. Az egyik, hogy emelt dózisban adják tovább az eredeti hatóanyagot (erre általában a terápia részleges kudarca esetén szokott sor kerülni). A másik lehetőség, hogy gyógyszert váltanak. Jelenleg ugyanis már újabb típusú célzott szerek is elérhetőek, amelyek szintén képesek a hibás enzim gátlására. A megváltoztatott kezelések 4-5 éves utánkövetési eredményei azt mutatják, hogy az újabb típusú gyógyszerek a rezisztenssé vált betegek jelentős hányadában képesek az eredeti siker helyreállítására.
Elsővonalbeli kezelésként egyelőre mindig a 2002-ben törzskönyvezett gyógyszert adják. Váltásra egyedül abban az esetben kerülhet sor, ha egy betegnél ez már nem tekinthető hatékonynak. A kezelés megváltoztatásában (dózisemelés vagy újabb gyógyszer, illetve az újabb gyógyszerek közül melyik) minden esetben a kezelőorvos dönt.
Tisztelt Olvasónk! Felhívjuk a figyelmét, hogy anyagaink tájékoztató és ismeretterjesztő jellegűek, így nem adhatnak választ minden olyan kérdésre, amely egy adott betegséggel vagy más témával kapcsolatban felmerülhet, és főképp nem pótolhatják az orvosokkal, gyógyszerészekkel vagy más egészségügyi szakemberekkel való személyes találkozást, beszélgetést és gondos kivizsgálást.