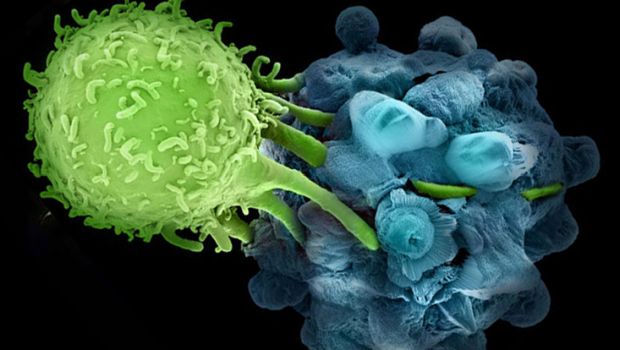
 Mára világszerte, így hazánkban is elérhetővé váltak az immunellenőrzőpont-gátló gyógyszerek
Mára világszerte, így hazánkban is elérhetővé váltak az immunellenőrzőpont-gátló gyógyszerekA választandó onkológiai kezeléseket egészen a közelmúltig a daganat lokalizációja és szövettana határozta meg, ez a rendszer azonban alapjaiban fog átalakulni a közeljövőben: az első immunterápiás gyógyszer után idén az első olyan hagyományos értelemben vett célzott daganatellenes gyógyszert is engedélyezték, ahol már nem a szövettan és a daganat lokalizációja az elsődleges a kezelés kiválasztásában, hanem a megfelelő molekuláris célpont jelenléte. A 2018-as év azért is jelentős, mert orvosi/élettani Nobel-díjjal jutalmazták két olyan kutató munkáját, akik elsőként jöttek rá arra, hogy miként lehet feloldani az immunsejtek daganatsejtek elleni aktivitását gátló fékeket.
Hírek, célzott terápiák:
Úton a daganatok oki terápiája felé - Dr. Peták István írása
A PortfoLion Zrt. kockázati tőkebefektetéssel segíti a KPS-t
Új immunterápiás gyógyszerek - a bispecifikus antitestek
Célzott terápiákkal egyre hatékonyabban kezelhető a rák
Háttéranyagaink:
"Az idei év egyik legfontosabb híre, hogy az élettani vagy orvosi kutatásokért járó Nobel-díjat két olyan kutató kapta, akik rájöttek arra, hogy szervezetünk immunrendszere - a megfelelő beavatkozásokkal - aktívan kihasználható a daganatos sejtek ellen folytatott küzdelemben. James P. Allison, a University of Texas MD Anderson Cancer Center kutatója és Taszaku Hondzso, a Kyoto University kutatója egyaránt olyan módszereket tártak fel, amelyekkel feloldhatóak azok a 'fékek', amelyek megakadályozzák az immunsejteket a daganatsejtek elpusztításában. Allison egy már korábban is ismert fehérjét - CTLA-4 - tanulmányozott, amellyel kapcsolatban felismerte, hogy a fehérje aktivitásának gátlásával feloldható az immunsejtek daganatsejtekkel szembeni inaktivitása, Taszuku pedig egy korábban ismeretlen fehérjével - PD-1 - kapcsolatban jutott ugyanerre a felismerésre. A CTLA-4 és a PD-1 gátlásának daganatellenes hatásait igazoló kezdeti vizsgálatokat követően gőzerővel indultak be a klinikai vizsgálatok, mára pedig világszerte, így hazánkban is elérhetővé váltak az immunellenőrzőpont-gátlók - angolul: immune checkpoint inhibitors - néven ismert gyógyszerek. A CTLA-4 gátlására alkalmas monoklonális antitestet jelenleg az előrehaladott melanoma kezelésében alkalmazzák törzskönyvezetten, a PD-1 gátlására alkalmas monoklonális antitesteket pedig a melanoma mellett a Hodgkin-limfóma, a nem-kissejtes tüdődaganat, valamint a húgyutakat érintő daganatok, így a vesedaganatok és a húgyhólyagdaganatok egyes típusai esetében kezdték elsőként alkalmazni" - mondja dr. Peták István, az Oncompass Medicine tudományos igazgatója.
Az orvostudományban ritkaság, hogy egy új felfedezést ilyen hamar Nobel-díjjal jutalmazzanak
"Nem szokott előfordulni, hogy egy új orvosi felfedezés ilyen hamar megkapja a Nobel-díjat: a CTLA-4 gátló gyógyszert 2011-ben, a PD-1 gátlókat pedig 2014-ben törzskönyvezték - mindkét esetben melanoma kezelésére, amelyeket a PD-1 gátlók esetében további daganattípusok is követtek - vagyis mindössze 7 év telt el az újfajta daganatellenes immunterápia klinikai alkalmazásának kezdete és a legrangosabb tudományos elismerés odaítélése között. Ez azt mutatja, hogy valódi áttörésről van szó: a különféle gének daganatot kiváltó mutációinak ismeretén alapuló célzott daganatellenes kezelések mellett az immunellenőrzőpont-gátlók váltak a daganatok ellen szintén célzottan bevethető új terápiás lehetőséggé. Érdemes kiemelni, hogy bár a hagyományosan célzottnak nevezett terápiák is óriási fejlődést hoztak a daganatokkal szembeni küzdelemben, ott egyelőre problémát jelent a gyógyszerek többségénél a daganatsejtekben kialakuló ellenálló képesség - rezisztencia - a modern immunterápiáknál a betegek jelentős részénél tartós hatásról beszélhetünk, amennyiben a kezelt beteg reagál a gyógyszerre" - mondja a kutatóorvos.

A 2018-as év orvosi/élettani Nobel-díjasai, Taszaku Hondzso és James P. Allison
Jó példa erre az előrehaladott melanoma: a CTLA-4 gátló gyógyszer 2011-es törzskönyvezését követően a Daganatok.hu is beszámolt annak a betegnek az esetéről, akinél a daganattal érintett területek némelyike már egy golflabda nagyságát is elérte, kórházba kerülésekor pedig nagyjából 6-9 hónapot jósoltak neki a kezelőorvosai. Ebből aztán a beszámoló időpontjában már 3 éve megőrzött tünetmentesség lett, ami valóban komoly eredmény, hiszen az előrehaladott melanoma gyógyszeres kezelésében ezt megelőzően már négy évtizede nem történt semmilyen jelentős áttörés.
Alapvető változás az onkológiai kezelésekben: a PD-1 gátlók egyik típusa lett az első olyan daganatellenes gyógyszer, amelyet egy bizonyos molekuláris diagnosztikai vizsgálat eredménye alapján már bármilyen daganattípusban alkalmazni lehet
"2017 május 23-adikán döntött úgy az amerikai gyógyszerengedélyeztetési hivatal, az FDA, hogy az egyik PD-1 gátló esetében elsőként engedélyezi a gyógyszer bármilyen daganattípusban történő alkalmazását az áttétes vagy sebészeti úton el nem távolítható esetekben akkor, ha a daganatnál jelen vannak bizonyos fajta genetikai eltérések. A genetikai eltérés egyaránt lehet a DNS hibajavításának egyik típusú zavara - az úgynevezett 'mismatch repair deficiencia' - vagy a mikroszatellita instabilitás. Itt kerül képbe a hagyományos célzott daganatellenes kezeléseknél már jól ismert és széles körben alkalmazott molekuláris diagnosztika, amelynek célja, hogy már a kezelések megkezdése előtt információt szolgáltasson az alkalmazni kívánt terápia várható hatásosságáról vagy épp hatástalanságáról. Az Oncompass Medicine szakemberei képesek mindazon molekuláris diagnosztikai vizsgálatok elvégzésére, amelyek alapján megmondható, hogy egy-egy tumorban jelen van-e DNS hibajavítási mechanizmusának imént említett formája vagy jelen van-e a mikroszatellita instabilitás. Ez utóbbi szintén a DNS hibajavítási mechanizmusához köthető jelenség: azt jelenti, hogy a hibajavításban résztvevő egyes gének meghibásodása miatt bizonyos ismétlődő DNS-szakaszok - mikroszatelliták - hossza megváltozik, például megrövidülnek vagy meghosszabbodnak" - hangsúlyozza a molekuláris diagnosztikai vizsgálatok immunterápiában betöltött szerepét dr. Peták István. Az intézet szakemberei minden náluk jelentkező daganatos betegnek konzultációs lehetőséget biztosítanak annak felmérésére, hogy az adott páciensnél milyen kezelés végezhető el, vagy épp mi az, ami egyáltalán nem javasolt (érdeklődni az itt található elérhetőségeken lehet).
"Alapvető változást jelent az onkológiában, hogy az említett PD-1 gátló megkapta az engedélyt arra, hogy a megfelelő molekuláris markerek jelenléte mellett bármilyen daganattípusban alkalmazni lehessen. Nagyon régen vártunk már arra ugyanis, hogy a választandó kezeléseket elsődlegesen már ne a daganat lokalizációja és a szövettan, hanem a molekuláris célpontok jelenléte határozza meg. Ebbe az irányba mutat az is, hogy 2018 novemberében az első olyan, hagyományos értelemben vett célzott daganatellenes gyógyszert is engedélyezte az FDA, amely bármilyen előrehaladott szolid tumorban alkalmazható, amelynél jelen van az NTRK génfúziója, ismert rezisztenciamutáció nélkül"
Régóta kérdéses volt, hogy az immunrendszer önmagától miért nem képes a daganatok elpusztítására. A feltételezett okok között szerepelt, hogy az immunsejtek nem ismerik fel idegenként a daganatsejteket (a rajtuk kifejeződő, normálistól eltérő fehérjék alapján), és ez az esetek egy részében feltételezhetően így is van. Megfigyelték ugyanakkor azt is, hogy bizonyos daganattípusok esetén fokozottá válik a fehérvérsejtek jelenléte a daganatszövetben, ami arra utal, hogy az immunrendszer mégiscsak idegenként ismerte fel a daganatsejteket.
Ismert volt az is, hogy a daganatsejtek olyan hormonszerű anyagokat (citokineket) és fehérjéket termelnek, amelyek gátolják az őket támadó immunsejteket, vagy egyenesen sejthalált idéznek elő bennük. A daganatsejtek által termelt citokinek olyan immunsejteket vonzanak a daganat közelébe, amelyek sejtfelszíni molekuláikkal (CD80/CD86) az immunsejtek felszínén található CTLA-4 fehérjéhez kötődnek, gátolva ezzel az immunsejtek aktivitását. A daganatsejtek egy másik védekező mechanizmusa, hogy a felszínükön található PD-L1 és PD-L2 fehérjék az immunsejtek felszínén található PD-1 fehérjékhez kötődnek, programozott sejthalált idézve elő ezzel az immunsejtekben.
A Nobel-díjas felfedezések jelentősége, hogy a kutatók rájöttek: orvosi biotechnológiai módszerekkel mindkét, az immunsejtek aktivitását fékező fehérje - a CTLA-4 és a PD-1 - is egyaránt gátolható, ezáltal pedig elkerülhető, hogy a daganatsejteket támadó immunsejtek elpusztuljanak. A gátláshoz mindkét esetben monoklonális antitestekre van szükség: ezek olyan gyógyszermolekulák, amelyek képesek hozzákötődni a két említett fehérjéhez, inaktiválva ezzel a működésüket, és felszabadítva az immunsejtek daganatsejtekkel szembeni aktivitását.
Az immunrendszer aktivitását fékező molekulák kikapcsolásával tehát bekapcsolható a daganatsejtek elleni hatékony immunválasz. Ezt a felfedezést követően elvégzett kezdeti klinikai vizsgálatok sikeresen igazolták, innen pedig már csak néhány év volt eljutni a korábbiakhoz képest teljesen újfajta hatásmechanizmussal jellemezhető immunellenőrzőpont-gátlók törzskönyveztetéséig.
Oncompass Medicine Precíziós Onkológiai Program
Az Oncompass Medicine molekuláris diagnosztikai laboratóriuma és információs központja a molekuláris diagnosztika legfrissebb eredményeit és módszereit alkalmazva igyekszik megtalálni a daganatos betegségben szenvedők számára az adott időpontban legmegfelelőbb kezelési lehetőségeket.
Miben tudunk segíteni?
A Precíziós Onkológiai Programunkban a személyre szabott onkológiai ellátás lehetőségeit mutatjuk be a daganatos betegek számára.
Minden daganatos megbetegedés genetikai eredetű, és számos, a daganatot okozó génhiba esetében már személyre szabott onkológiai kezelés adható. A molekuláris diagnosztika a daganatos betegség okát tárja fel, az azonosított génhibák alapján egy speciális onkológiai szoftver segítségével meghatározzuk a daganat támadáspontját (molekuláris célpont) és a célponttal összefüggésbe hozható személyre szabott gyógyszereket. A személyre szabott onkológiai ellátáshoz több feltételnek kell megfelelnie, ennek felméréséhez kérjen időpontot személyes konzultációra!
A személyre szabott kezelési terv minden olyan daganattípusban felállítható, amelyben az azonosított génhibáknak megfelelő kezelés elérhető.
Virtuális Molekuláris Tumor Board
A VMTB szolgáltatás keretében az Oncompass Medicine egyedülálló módon kezelőorvosok és onkoteamek számára biztosít szakmai támogatást annak érdekében, hogy betegeiknek a nemzetközi ajánlásoknak megfelelő, legkorszerűbb precíziós onkológiai ellátást nyújthassák.
Az Oncompass Precíziós Onkológiai Program keretében igénybe vehető szolgáltatás során rugalmasan igazodunk a klinikusi igényekhez, a hét bármely napján, különböző időpontokban biztosítunk lehetőséget az esetek megbeszélésére, amely az adatvédelmi előírásoknak megfelelően, biztonságos online platformon történik.
(hirdetés)
Tisztelt Olvasónk! Felhívjuk a figyelmét, hogy anyagaink tájékoztató és ismeretterjesztő jellegűek, így nem adhatnak választ minden olyan kérdésre, amely egy adott betegséggel vagy más témával kapcsolatban felmerülhet, és főképp nem pótolhatják az orvosokkal, gyógyszerészekkel vagy más egészségügyi szakemberekkel való személyes találkozást, beszélgetést és gondos kivizsgálást.