Kép: BGI Americas
Kép: BGI AmericasA Science hírportáljának beszámolója szerint 10 000 újabb tumorminta teljes genetikai állományát elemeznék az összes fontos daganattípusban. Összehasonlításképpen: a 2006 óta folyó egyik nagy projektben nem ráktípusonként, hanem összesen szerepelt ennyi tumorminta. A terveket néhányan kritikával illetik - mondván, hogy inkább a jelátviteli utak működésének alaposabb megértésével kellene foglalkozni - az amerikai Nemzeti Rák Intézet tudományos tanácsadói szerint azonban érdemes lenne belekezdeni a munkába.
Hírek, célzott terápiák:
Úton a daganatok oki terápiája felé - Dr. Peták István írása
A PortfoLion Zrt. kockázati tőkebefektetéssel segíti a KPS-t
Új immunterápiás gyógyszerek - a bispecifikus antitestek
Célzott terápiákkal egyre hatékonyabban kezelhető a rák
Háttéranyagaink:
"Még nincs szó konkrét projektről, egyelőre csak az ötlet szintjén merült fel, hogy ezzel a munkával kellene folytatnunk a The Cancer Genome Atlas névre keresztelt, 2006-ban megkezdett munkát" - mondta a Science hírportáljának Louis Staudt, az amerikai Nemzeti Rák Intézet tudományos tanácsadó testületének egyik tagja.
A testület március 4-ei, legutóbbi találkozóján Staudt volt az, aki felvázolta, hogy mi lehetne az egyik lehetséges folytatása annak a munkának, amelyben eddig 20-féle daganattípus 500 tumormintáját, összesen tehát 10 000 tumorminta teljes genetikai állományát azonosították. (A találkozó teljes videófelvétele itt nézhető meg, Staudt a 116. percnél kezd beszélni.)
Ez a munka 7 éve tart, eddig több mint 375 millió dollárba került, eredménye pedig, hogy a Rákgenom Atlaszban (TCGA) mára rengeteg adat összegyűlt azokkal a génmutációkkal kapcsolatban, amelyek összefüggenek, vagy egyenesen oki tényezőt jelentenek a daganatok különféle típusainak kialakulásában.
Még mindig nincs meg az összes fontos mutáció
A Rákgenom Atlasz projektje 2014-ben fog lezárulni, és bár néhányan sokallták a költségeit - és kevesellték az eredményeit - sok újdonságot meg lehetett belőle tudni a rák kialakulásának oki tényezőit jelentő génekről és ezek mutációiról.
Ahogyan korábbi, összefoglaló cikkünkben írtuk: a fő kérdés mostantól már nem az lesz, hogy milyen mutációk fordulnak elő a tumorokban, hanem hogy a daganatok kialakulásban pontosan milyen szerepet játszanak ezek a DNS-hibák.
A Rákgenom Atlasz egyik értelmes folytatása Louis Staudt szerint az lehetne, ha a 20-féle, eddig vizsgált ráktípusnál ezúttal már nem csak 500, hanem típusonként 10 000 tumorminta teljes genetikai állományát határoznák meg. Ennek egyik fő célja az lenne, hogy a rák kialakulásában oki szerepet játszó, ámde nagyon ritka rákgéneket (onkogéneket) is sikerüljön azonosítani.
A már meglévő adatok elemzésénél egyelőre problémát okoz, hogy a tumormutációk nagyobb része nem játszik szerepet a daganatkialakulásban. Emiatt igen nehéz megtalálni azokat, amelyek viszont oki tényezőt jelentenek. "Az egyik legjobb példa erre a tüdő mirigyhámjából kiinduló rosszindulatú daganat, a tüdő adenokarcinóma. Ez az egyik legintenzívebben kutatott ráktípus, így nagyjából már ismerjük a kialakulásában szerepet játszó rákgéneket. Mégis, két olyan rákgén is akadt, amelyeknek az egyébként már ismert mutációi nem bukkantak fel a tumorgenom-vizsgálatokban" - hívja fel a figyelmet egy fontos hiányosságra Staudt.
Száz eset a tízezerből - a ritka mutációkat is megkeresnék
Staudt egy újabb, a korábbinál még kiterjedtebb vizsgálatsorozatban látja a megoldást. Ráktípusonként ezúttal már nem csak 500, hanem 10 000 tumorminta teljes genetikai állományát kellene átvizsgálni a szakember szerint. Ez ugyanis már kellően nagy mintaszám lenne ahhoz, hogy azokat a mutációkat is megtalálják, amelyek a tumorok mindössze 1 százalékában vannak csak jelen, és még nem ismertek a rákkutatók előtt.
A tervezett projekt másik előnye Staudt szerint az lenne, hogy a mintákat szolgáltató betegek klinikai kezelésének eredményeit is összegyűjtenék, majd összevetnék őket a daganatban előforduló mutációkkal. A mutációk adatsorait ezen kívül életmódbeli faktorokkal - például a dohányzás jelenléte vagy hiánya - is összepárosítanák, ami a Rákgenom Atlasz összeállítása során szintén nem történt meg - írja a Science hírportálja.
A nagyszámú minta összegyűjtése egyébként nem lenne probléma. Kiderült ugyanis, hogy a genetikai állomány vizsgálatára a paraffinban tárolt tumorbiopsziák is felhasználhatóak, nemcsak a sokkal ritkább, fagyasztva tárolt szövetminták. A mintákat ezen kívül nem csak a már befejezett klinikai vizsgálatokból, hanem az újonnan indulókból is begyűjtenék.
Ezek egyike lehetne például az ALChEMIST névre keresztelt vizsgálat. Ebben 7000 tüdőrákos betegnél végeznek majd molekuláris diagnosztikai vizsgálatot annak érdekében, hogy kiválasszák a páciensek azon 16%-át, akiknél kétféle génben van jelen kétféle mutáció. Ők lesznek azok, akik az újfajta célzott kezelés gyógyszervizsgálatában is részt vehetnek majd.
A rákgenomikai kutatások alapproblémája: mit kezdünk a sok adattal?
A közeljövőben egyébként nemcsak 20, hanem 50-féle tumortípus és altípus mutációs adataihoz férhetnek majd hozzá a kutatók. Az adatok egy része - egészen pontosan 7774 rákgenomé - már most is szabadon hozzáférhető a Nemzetközi Rákgenom Konzorcium honlapján.
Ez komoly eredmény, ettől azonban - hívja fel a figyelmet néhány kutató - nemhogy egyszerűbbé, hanem éppen ellenkezőleg, még összetettebbé válik daganatokról alkotott eddigi képünk. A fő kérdés innentől ugyanis már az, hogy miként lehet majd a mutációkkal kapcsolatos információtömeget a rákbetegek szempontjából is értékelhető módon felhasználni?
Az egyik legnehezebb feladat a már azonosított mutációk funkció szerinti kategorizálása. A mutációk nagyobb része ugyanis utazó (passenger) mutáció, amelyek nem vesznek részt a tumorkialakulás folyamatában. A sikeres rákkezelés szempontjából az irányító (driver) mutációkon van a hangsúly, amelyek egyaránt érinthetik a daganatkialakulást elősegítő onkogéneket és a daganatelnyomó (tumorszupresszor) géneket is.
A daganatelnyomó gének nem jó gyógyszercélpontok
Ezen a ponton egy újabb probléma is adódik, amit többek között az elismert rákkutató, Bert Vogelstein tett szóvá. A Science hírportáljának 2010-ben például azt mondta, hogy a jövőbeli rákgyógyszerek célpontjaiként nem is annyira a géneket, mint inkább a nagyrészt már jelenleg is ismert jelátviteli utakat kellene megtenni.
"Azért mondom ezt, mert a most ismert 320 irányító mutáció 90%-a a daganatelnyomó, tumorszupresszor géneket érinti. Ezek pedig sajnos nem jó gyógyszercélpontok. Ilyenkor a mutációk miatt kikapcsolódott géneket kellene újra bekapcsolni, ami sajnos igen nehéz feladat" - érvelt Vogelstein, aki egy ideje inkább olyan géntesztek vizsgálatával foglalkozik, amelyekkel a lehető leghamarabb diagnosztizálni lehetne az egyes ráktípusokat.
Vogelstein akkori szavait természetesen erős kritikával illette a Rákgenom Atlaszt koordináló Nemzeti Rák Intézet két főmunkatársa, Anna Barker és Mark Guyer: "Egyszerűen nem értjük, hogyan állíthatja valaki, hogy 100 tumorgenom ismeretéből is kideríthető lenne mindaz, amit százszor ennyi minta elemzéséből fogunk megtudni."
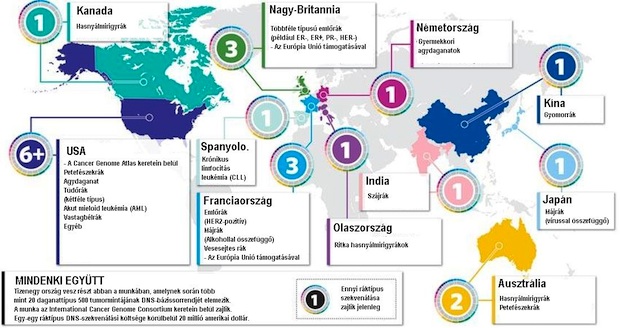
A fenti térkép azokat az országokat mutatja, amelyek a Nemzetközi Rákgenom Konzorcium (ICGC) irányításával vesznek részt a különféle ráktípusok genomelemzésében. A Rákgenom Atlasz (TCGA) 2014-ben befejeződő projektjének eredményeként 10 000 tumor teljes genetikai állománya lesz ismert. A Rákgenom Atlasz a Nemzetközi Rákgenom Konzorcium még átfogóbb projektjének részeként működik, amelynek végső célja összesen 50-féle ráktípus/altípus 25 000 tumormintájának genomikai elemzése. A teljes munka várható összköltsége összesen 1 milliárd dollár. Kattintson ide vagy az ábrára a nagyításhoz!
* * *
Kapcsolódó anyagok:
Korábbi összefoglaló cikkünk: A ráksejtek birodalmát a genetika döntheti meg
A Science hírportáljának 2013. márciusi cikke: Ready for More 10,000 Cancer Genomes Projects?
A Science hírportáljának 2010-es anyaga Bert Vogelstein rákgenom projektekkel kapcsolatos, szkeptikus álláspontjáról: A Skeptic Questions Cancer Genome
A Science portréja Bert Vogelsteinről: Cancer Genetics With an Edge
A Nature News 2010. áprilisi cikke: Big science - The cancer genome challenge
Oncompass Medicine Precíziós Onkológiai Program
Az Oncompass Medicine molekuláris diagnosztikai laboratóriuma és információs központja a molekuláris diagnosztika legfrissebb eredményeit és módszereit alkalmazva igyekszik megtalálni a daganatos betegségben szenvedők számára az adott időpontban legmegfelelőbb kezelési lehetőségeket.
Miben tudunk segíteni?
A Precíziós Onkológiai Programunkban a személyre szabott onkológiai ellátás lehetőségeit mutatjuk be a daganatos betegek számára.
Minden daganatos megbetegedés genetikai eredetű, és számos, a daganatot okozó génhiba esetében már személyre szabott onkológiai kezelés adható. A molekuláris diagnosztika a daganatos betegség okát tárja fel, az azonosított génhibák alapján egy speciális onkológiai szoftver segítségével meghatározzuk a daganat támadáspontját (molekuláris célpont) és a célponttal összefüggésbe hozható személyre szabott gyógyszereket. A személyre szabott onkológiai ellátáshoz több feltételnek kell megfelelnie, ennek felméréséhez kérjen időpontot személyes konzultációra!
A személyre szabott kezelési terv minden olyan daganattípusban felállítható, amelyben az azonosított génhibáknak megfelelő kezelés elérhető.
Virtuális Molekuláris Tumor Board
A VMTB szolgáltatás keretében az Oncompass Medicine egyedülálló módon kezelőorvosok és onkoteamek számára biztosít szakmai támogatást annak érdekében, hogy betegeiknek a nemzetközi ajánlásoknak megfelelő, legkorszerűbb precíziós onkológiai ellátást nyújthassák.
Az Oncompass Precíziós Onkológiai Program keretében igénybe vehető szolgáltatás során rugalmasan igazodunk a klinikusi igényekhez, a hét bármely napján, különböző időpontokban biztosítunk lehetőséget az esetek megbeszélésére, amely az adatvédelmi előírásoknak megfelelően, biztonságos online platformon történik.
(hirdetés)
Tisztelt Olvasónk! Felhívjuk a figyelmét, hogy anyagaink tájékoztató és ismeretterjesztő jellegűek, így nem adhatnak választ minden olyan kérdésre, amely egy adott betegséggel vagy más témával kapcsolatban felmerülhet, és főképp nem pótolhatják az orvosokkal, gyógyszerészekkel vagy más egészségügyi szakemberekkel való személyes találkozást, beszélgetést és gondos kivizsgálást.